近期,公司张彦中教授课题组在仿生纤维用于组织再生研究领域取得最新进展,相关成果以“Stiffness of Aligned Fibers Regulates the Phenotypic Expression of Vascular Smooth Muscle Cells”和“Stiffness of the Aligned Fibers Affects Structural and Functional Integrity of the Oriented Endothelial Cells”为题,分别发表于生物材料相关领域的主流期刊《ACS Appl. Mater. Interfaces》和《Acta Biomater.》上。两篇论文的第一作者均为化生学院博士生易兵成。
心血管疾病,尤其是因血栓形成或动脉硬化等造成体内小口径血管堵塞,是引起死亡的重要原因之一。研发组织工程化血管(TEBVs)可为解决此类问题提供最有希望的解决途径。目前,领域内研究者在TEBVs的结构设计(更侧重仿生策略)、表面功能改性(如肝素、RGD活性成分的嫁接)等方面已取得较大进展,且证实短时间内可完全替代血管组织实施血管功能。但TEBVs长期植入体内后仍出现的血栓形成、内膜增生等并发症导致的低通畅率问题严重制约了其临床应用转化,一个重要原因是TEBVs与天然血管的刚度不匹配性。尽管已有研究证实基质刚度与血管细胞(血管平滑肌细胞SMCs和内皮细胞ECs)间的关联性,但这些研究大都忽视了这两类重要血管细胞层的各向异性细胞形态特点。另一方面,虽然细胞形态与细胞功能密切相关,且通过采用取向纤维可实现对细胞方向性排列的有效诱导,但具有各向异性形态的细胞在功能上是否具有健康的细胞功能仍有待明晰。因此,深入研究取向性SMCs和ECs与血管支架刚度的依赖关系,将对基质刚度在血管生理/病理重塑中的作用提供更有针对性和更深入的认识。
针对以上问题,张彦中教授课题组基于近年来所发展的一种稳定射流同轴电纺技术(SJCES),选用刚性的聚乳酸(PLLA)作为芯层材料,弹性的乳酸-己内酯共聚物(PLCL)作为壳层材料,通过调控单根纤维壳-芯厚度比例改变纤维刚度。结果表明,在控制纺丝液总注射速率0.5 mL/h的前提下逐渐提高芯层溶液PLLA纺丝液的注射速率,可在不影响整体纤维取向度和单根纤维直径情况下,有效调控单根纤维的弹性模量在14.68~2141.72 MPa范围变化,从而在一定程度上仿生天然血管的健康和病态下的组织刚度(图1)。
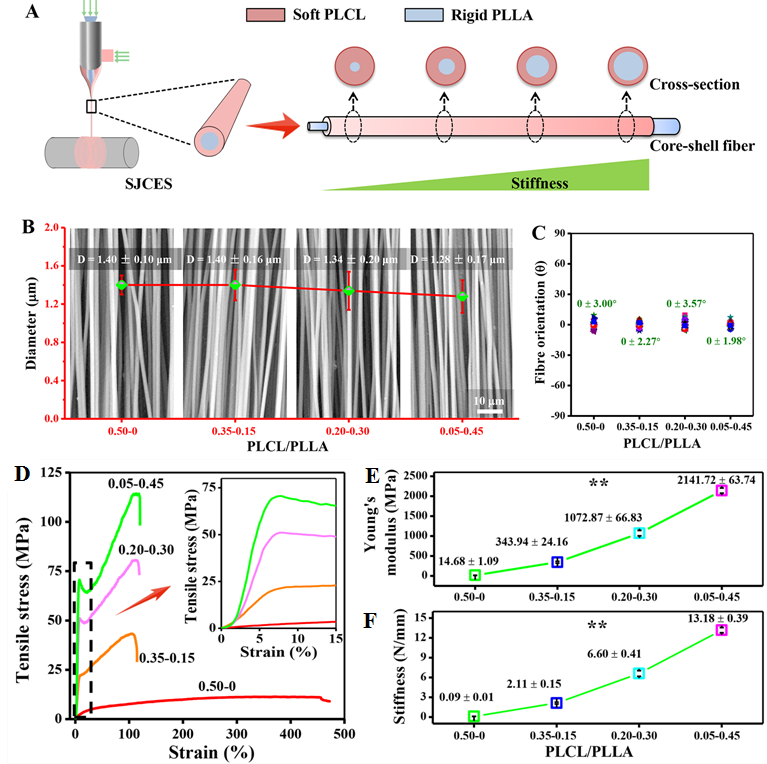
图1 基于单根纤维壳芯厚度调控策略,采用SJCES技术制备四种不同刚度的取向纤维:A)SJCES技术制备刚度可调的壳芯结构取向纤维示意图;B)取向纤维的直径无显著性差异;C)取向纤维的取向度无显著差异;D)取向纤维的拉伸应力-应变曲线;E)杨氏模量分析;F)刚度分析(改变芯层PLLA含量可使复合纤维的刚度调控范围近150倍)
基于上述取向纤维,课题组首先探索了取向纤维刚度对人脐动脉平滑肌细胞(huaSMCs)功能表达的影响。结果证实,取向纤维刚度的变化对细胞形貌无显著性影响,但却促进了huaSMCs中F-肌动蛋白应力纤维的形成,导致细胞增殖和迁移能力的增强,细胞表型向合成型、病态表型转变(如收缩型标志物a-SMA、SM-MHC、Calponin和Desmin表达下调,病变型标志物OPN表达上调)。同样,刚度过高的取向纤维也会促进huaSMCs由收缩型向类巨噬细胞表型转变,分泌炎症因子募集炎症细胞(如白细胞和巨噬细胞),破坏内皮细胞的完整性和促进SMCs的过度增殖,造成血栓形成和内膜增生的发生(图2A)。从材料选择角度看,该研究结果也表明,虽然电纺PLLA纤维的微纳米尺寸能够赋予支架一定的柔软性,但与弹性的PLCL相比,PLLA并不是构建血管组织工程支架的最佳材料选项。重要的是,论文结果强调血管细胞的形态‘正确’并不意味着其具有‘正确’的细胞功能这一重要研究结论,虽然有较多研究证明高度有序的血管细胞层更有利于维持细胞的功能表达。
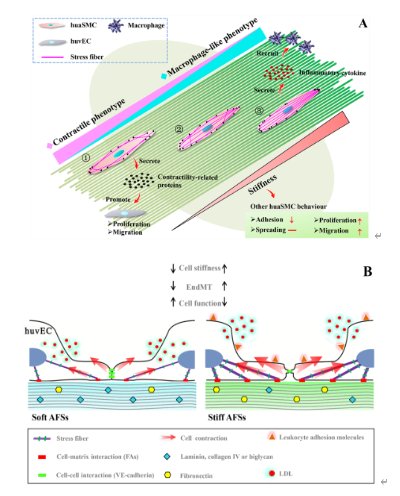
图2 取向纤维刚度对huaSMCs(A)和huvECs(B)功能表达的影响
在上述工作的基础上,课题组继续探索了取向纤维刚度对另一重要血管细胞——取向内皮层结构和功能完整性的影响。结果证实,提高取向纤维刚度可通过增强细胞-基质间相互作用,促进人脐静脉内皮细胞(huvECs)的粘附和细胞膜张力,但并不影响细胞铺展行为。刚度提高促进huvECs内的应力纤维形成,通过提高细胞自身收缩力破坏再生内皮层的细胞-细胞间相互作用,导致huvECs细胞层致密完整性的破坏,使huvECs的迁移和增殖能力增强并降低其表达健康的功能表型和对支架的重塑能力。该结果强调在仿生天然细胞形态基础上研究基底刚度对huvECs行为影响的重要性,证实取向纤维虽能诱导huvECs形成仿生天然血管内皮层形态的取向细胞层,但支架刚度仍是影响细胞功能紊乱、破坏再生内皮层完整性的重要因素(图2B)。这进一步印证了血管细胞的形态‘正确’并不意味着其具有‘正确’的细胞功能这一结论。
通过电纺丝方法制备的纳-微米超细纤维,因其纤维细度可模拟天然细胞外基质中纤维成分的超细度特点而被称为“仿生纤维”,并已被广泛应用于各种组织工程研究。上述研究结果为在血管组织工程中理解体内血管病理及基于仿生纤维的血管组织工程支架的设计和仿生构建提供参考价值。该研究工作得到了国家重点研发专项、中央高校学科交叉重点计划项目、中央高校博士创新基金和国家自然科学基金等项目的大力资助。
论文链接:
https://doi.org/10.1021/acsami.9b00293
https://doi.org/10.1016/j.actbio.2020.03.022

